Působení bludných proudů na kovové konstrukce a jejich degradace (2)
11. 8. 2021 | doc. Ing. František Veselka, CSc.| UVEE FEKT VUT v | www.vutbr.cz
Mimo porušení kovů houževnatými, křehkými a únavovými lomy, které jsou způsobeny vztahy mezi stavem materiálu a mechanickým namáháním, jsou známy velmi četné případy vzniku trhlin a lomů při současném působení korozního prostředí.
(pokračování z ELEKTRO 4/2021)
Korozní trhliny a lomy
Mimo porušení kovů houževnatými, křehkými a únavovými lomy, které jsou způsobeny vztahy mezi stavem materiálu a mechanickým namáháním, jsou známy velmi četné případy vzniku trhlin a lomů při současném působení korozního prostředí. Vznik lomů v korozním prostředí se připisuje současnému působení prostředí a mechanického namáhání, event. spolupůsobení vnitřního pnutí a to proto, že jejich současným působením vzniká lom mnohem snáze než při samotném mechanickém namáhání materiálu nebo při mechanickém namáhání po působní samotného korozního prostředí, za jinak stejných podmínek.
Korozní trhliny a lomy vznikají při různých druzích mechanického namáhání, např. tahem, smykem, krutem, ohybem, aj., ale jejich vznik byl dosud pozorován jen v tahové části působícího napětí; nebyly zjištěny při mechanickém namáhání působeném pouhým tlakem.
Přestože trhliny a lomy vznikají u různých materiálů a za nejrůznějších podmínek a jejich tvar i doba vzniku jsou rozdílné, probíhají buď po hranicích, nebo uvnitř zrna a můžeme je shrnout do několika následujících základních tvarů:
1) Trhliny probíhají zrny kovu – transkrystalově, jsou úzké a na povrchu kovu není patrno korozní centrum.
2) Trhliny probíhají po hranicích zrn – mezikrystalově, jsou úzké a na povrchu kovu není patrno korozní centrum.
3) Trhliny vycházejí ze zřejmého korozního centra na povrchu kovu a jejich další průběh pod tímto centrem může být jak mezikrystalový, tak i transkrystalový.
4) Trhliny jsou při korodovaném povrchu široké a do hloubky se značně zužují, až dostávají tvar mezikrystalové nebo transkrystalové trhliny.
5) Trhliny probíhají podél povrchu kovu a jsou soustředěny v pásu určité šířky.
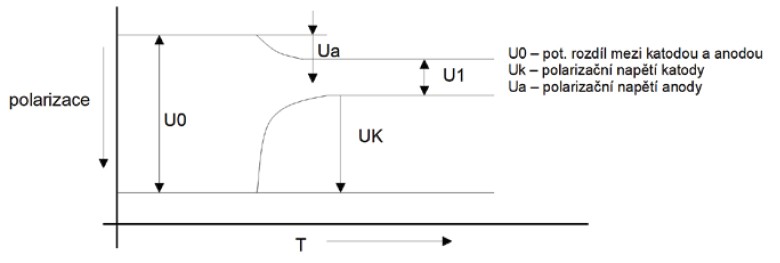
Obr. 10. Schéma průběhu polarizace korozních elektrod [2]
Koroze chemická
Chemická koroze nastává především v plynném prostředí za vyšších teplot, např. účinkem vzdušného kyslíku, kysličníku siřičitého, vodíku a jiných plynů. Příkladem je vznik kysličníkové vrstvy na mědi ve vzduchu podle rovnice:![]()
Značně agresivní plyny jako kysličník siřičitý, sirovodík a plyny, obsahující síru, porušující kromě železa i měď, nikl a jeho slitiny, stříbro a jiné kovy. Chemická koroze někdy probíhá stále stejnou rychlostí. Vznikající vrstva korozních produktů je pak pórovitá nebo má četné trhlinky a nepřekáží pronikání částic okolního prostředí k povrchu kovu. Proto se podmínky koroze s časem nemění, rychlost koroze zůstává stálá a tloušťka vrstvy kovu zničeného korozí roste s časem lineárně. Čím tlustší je vrstva kysličníku, tím pomaleji se její tloušťka zvětšuje, tj. tím pomaleji probíhá další koroze, ovšem pokud se tlustší vrstva neodloupne.
Koroze elektrochemická, standardní a korozní potenciály kovů
Elektrochemická koroze je děj, při němž se kov stýká s elektrolytem a vysílá do něj své ionty. Každý přestupující iont zanechává v kovu jeden elektron (je-li kov jednomocný). Ionty kovů jsou kladné, takže elektrolyt se stává kladnějším a zároveň kov (nazývaný elektrodou) se stává zápornější. Mezi elektrodou a elektrolytem vzniká tak určité elektrické napětí, nazývané elektrodový potenciál. Hodnota elektrodového potenciálu závisí nejen na povaze kovu, ale i na elektrolytu. Čím koncentrovanější je elektrolyt, tj. čím více obsahuje iontů daného kovu, tím nesnadněji vysílá elektroda do elektrolytu další své ionty. Proto s rostoucí koncentrací elektrolytu hodnota elektrodového potenciálu klesá a naopak s klesající koncentrací elektrolytu hodnota elektrodového potenciálu vzrůstá.
Tab. 2.1 Potenciály kovů vůči elektrolytu [2].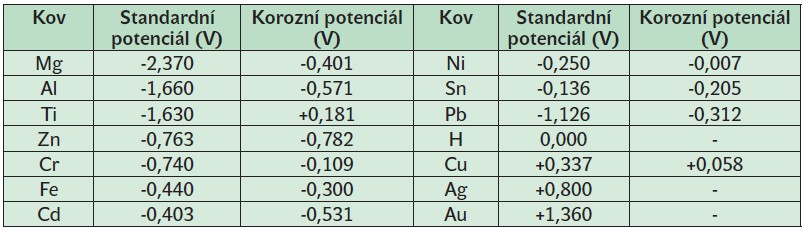
Polarizace a depolarizace
Hodnoty elektrodového potenciálu platí pouze pro začátek koroze, kdy je povrch kovu čistý. Zakrátko však korozi začnou zpomalovat pochody, jež nazýváme polarizace. Polarizace se projevuje tím, že počáteční rozdíl potenciálů mezi katodou a anodou se zmenšuje, takže potenciály anody a katody se sbližují. Polarizací anody i katody se tedy zmenšuje rozdíl potenciálů. Příčinou polarizace jsou chemické změny, jež v průběhu koroze nastávají nejen na povrchu kovu, ale i v korozním prostředí v blízkosti kovu. Polarizaci katody mohou vyvolat zejména vodíkové ionty, hromadí-li se na jejím povrchu, čímž brání dalším iontům v přístupu.
Opačně působí jev depolarizace. Depolarizací se tedy koroze opět urychluje.
Pasivita kovů
Značný záporný standardní potenciál nemusí vůbec znamenat, že určitý kov bude opravdu silně korodovat. Tento stav, kdy neušlechtilý kov odolává korozi v určitém prostředí nazýváme pasivitou. Příkladem je hliník, který je velmi neušlechtilý, ale v normální atmosféře značně odolává. Obdobně jako hliník na vzduchu pasivuje též chróm.
Inhibitory
Určité chemické látky mají schopnost svou přítomností v korozním prostředí zmenšit pronikavě rychlost koroze kovů. Nazývají se inhibitory. Dočasnou ochranu hotových ocelových výrobků před korozí umožňují inhibitory vypařovací. Příkladem je dicyklohexylaminnitrit.
Opačně než inhibitory působí stimulátory. Jsou to látky, které korozi za daných podmínek urychlují, např. amoniak je stimulátorem koroze mědi a jejich slitin.
Atmosférická koroze
Koroze atmosférická je nejčastější elektrochemickou korozí. Je podmíněna vrstvičkou vody, tzv. vodním filmem, který se vytvoří na povrchu kovu absorpcí vodních par ze vzduchu. Tato vrstvička je elektrolytem. Vzniká, když vzduch neobsahuje ještě tolik vodní páry, aby nastalo viditelné orosení povrchu kovu. Vodní film v sobě rozpouští vzdušný kyslík, který pak působí jako depolarizátor korozního děje. Dále rozpouští kyselinotvorné plyny, jako kysličník uhličitý a kysličník siřičitý, které se do atmosféry dostávají z kouřových plynů. Tyto nečistoty již při nízkých koncentracích ve vzduchu neobyčejně rychle urychlují korozi. Škodlivý je i prach, který se usazuje na povrchu kovu, který tím zdrsňuje a tím usnadňuje vytvoření vodního filmu.
Korozní agresivita atmosféry je určována hlavně spolupůsobením vlhkosti a nečistot ve vzduchu. Nečistoty jsou kyselinotvorné plyny a páry, soli a prach. Agresivita prostředí se též zvyšuje s větší četností kondenzací vodní páry na povrchu kovu. Ostatní činitelé atmosféry jako déšť, průměrná teplota, vítr, sluneční záření, aj. nemají rozhodující vliv na korozi kovů.
Při atmosférické korozi je velmi nápadný rozdíl mezi železem a neželeznými kovy. Korozní produkty neželezných kovů mohou totiž chemicky vázat a tím zneškodnit korozně aktivní látky, např. kyselinu sírovou, vzniklou z kysličníku siřičitého obsaženého ve vzduchu. Tak na zinku nebo mědi může vznikat nerozpustný zásaditý síran, který pak kov chrání před další korozí. U železa se rez neváže, nýbrž uvolňuje za přítomnosti vlhkosti, čímž průběh koroze podporuje. Rezavění železa vysvětluje následující schéma. Vznikne-li na povrchu železa vodní film, začnou korodovat anodická místa povrchu, jež jsou uprostřed kapky. Povrch blízko kapky působí jako katoda, protože tam se vody více obohatí kyslíkem pohlceným ze vzduchu. Tím na povrchu železa vznikne tenká vrstva kysličníku, čímž se tam kov stává o něco ušlechtilejší. Tak vznikne korozní článek. Na katodě probíhá depolarizační reakce: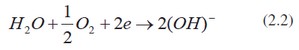
tato reakce je podmíněna přítomností vody, přístupem vzdušného kyslíku a přísunem elektronů. Vzniklé ionty OH- vstupují do vody, setkávají se s ionty železa Fe++ a slučují se s nimi na Fe(OH)2 . Ten se dalším kyslíkem zoxiduje na nerozpustný hydroxid železitý Fe(OH)3, jenž je hlavní součástí rezu. Rez je tuhá zplodina atmosférické koroze železa.
![Obr. 11. Znázornění děje rezavění železa v kapce vody [2]](/img/content/o2.jpg)
Obr. 11. Znázornění děje rezavění železa v kapce vody [2]
Koroze strukturní
Obzvlášť nebezpečným druhem koroze je koroze mezikrystalová. Pokračuje do hloubky jen podél hranic zrn (krystalů) a vede až k úplnému zničení součásti. Přitom nemusí na povrchu být nápadné stopy napadení. Druhy korozního napadení jsou uvedeny v [2].
Elektrochemické procesy
Elektrochemické pochody na konstrukci probíhají takto: předpokládejme napřed, že potrubí je anodou a okolí katodou. Elektrický proud tedy prochází od potrubí k okolí. V tomto případě přechází kov potrubí do roztoku a putuje ke katodě. V opačném případě, kdy je okolí anodou a potrubí katodou, vyvíjí se na nerozpustné anodě kyslík a na katodě vodík. Zde tedy putují produkty disociace vody – vodík a kyslík – k elektrodě opačné polarity.
Schopnost vzduchu jímat vodu značně závisí na teplotě. Při 20 °C může vzduch pojmout 22 g vody na krychlový metr při 100% relativní vlhkosti. Kritického prahu 5 až 6 gm-3 je dosaženo při –5 °C.
Soustava kov – plyn
V soustavách kov – plyn jsou příčinou koroze heterogenní reakce, z nichž mnohé probíhají za vyšších teplot, kde zanedbání závislosti tepelných kapacit na teplotě nemusí již být bez významu. Pokud není přesně známa změna tepelných kapacit s teplotou, nebo k rychlejšímu výpočtu rovnovážné konstanty K, resp. změny volné entalpie ΔG°, používá tzv. Ullichovy rovnice.
Rovnovážnou konstantu je možno vypočítat pro různé teploty pouhým sčítáním hodnot β. Hirschwald a Knacke ukázali použití této funkce na systému skládajícím se z šesti pevných fází a z jedné plynné, obsahující tři složky – měď, síru a kyslík.
Měď s kyslíkem a sírou může dát zhruba pět hlavních valenčních sloučenin: kysličník měďný, měďnatý, sirník měďný a měďnatý a síran měďnatý. Mezi těmito pěti tuhými fázemi a mědí může vlivem plynné fáze složené z kysličníku siřičitého a sírového dojít k patnácti reakcím. Pro tento soubor reakcí lze vypočíst na základě tabelovaných funkcí β patnáct rovnovážných konstant, vyjádřit závislost rovnovážných tlaků kysličníku siřičitého a sírového a určit oblasti stability jednotlivých sloučenin mědi vzhledem k teplotě a složení atmosféry.
Kov – vodní roztok
Podle Nernsta jeví každý kov větší snahu o vyslání svých vlastních iontů do roztoku. V důsledku malé afinity elektronů k iontům a velké solvatační (ve vodě hydratační) energie, která se při rozpuštění uvolňuje, mají neušlechtilé kovy větší rozpouštěcí tlak než kovy ušlechtilé. Při ponoření kovů do roztoku svých vlastních iontů – pokud jsou vyloučeny jiné reakce než přechod iontů z kovu do roztoku nebo opačně – dochází za kratší nebo delší dobu k ustálení potenciálu. Jeho velikost je možno zjistit pouze ve spojení sreferenční elektrodou, např. vodíkovou, tedy měřením elektromotorické síly článku. její závislost na koncentraci nebo přesněji na aktivitách vyjadřují rovnice v důsledku přechodové reakce typu: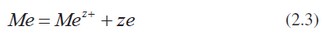
Reverzibilní potenciály se mohou ustavovat též u elektrod , kde se ustavuje rovnováha mezi aktivní složkou roztoku a nerozpustnou solí, kterou je elektroda pokryta:![]()
Při korozních dějích převládají většinou ireverzibilní pochody, měřené potenciály jsou vzdáleny od rovnovážného stavu a často jsou výsledkem několika reakcí (tzv. potenciály smíšené). Přesto je možno pomocí reverzibilních potenciálů konstruovat diagramy potenciál – pH a z nich předvídat možnosti koroze.
Diagram potenciál – pH pro soustavu měď – voda
K sestavení přehledného diagramu potenciál – pH je třeba znát všechny reakce, podle nichž mohou probíhat korozní pochody, nebo jejich průběh ovlivnit. K výpočtu je pak nutné mít k dispozici všechny termodynamické údaje s dostatečnou správností (entalpie, entropie, chemické potenciály). Při sestavování diagramu je účelné roztřídit reakce na homogenní a heterogenní, na reakce závislé pouze na potenciálu, na pH, případně závislé nejen na potenciálu, ale i na pH. U reakcí které jsou provázeny uvolňováním elektronů, má význam výpočet rovnovážného potenciálu (E). Je-li E pozitivní (negativní), pak uvažovaná reakce může probíhat samovolně zleva doprava (zprava doleva). Např. u reakce: ![]()
Diagram se dá využít k odečítání napětí potřebného ke katodické nebo anodické ochraně a také k odečtení teoretického napětí potřebného k elektrolýze. K sestrojení diagramu potenciál-pH je třeba znát termodynamické hodnoty s dostatečnou přesností. V silně oxidačních prostředích sestávají hranice korozních oblastí v podstatě ze dvou trojúhelníkových ploch. Při pH menším než 9,6 je železo v roztoku přítomno jako železnatý iont, při pH větším než 12,2 jako FeO2H- . Spodní mez této části je šikmá čára, horní hranice je vodorovná čára, která odpovídá železu s vrstvou kysličníku železitého. Pasivace může nastat pouze tehdy, jeli železo kryto adherentní a neporézní vrstvou a nejsou-li přítomny ionty, které by ji poškozovaly nebo bránily jejímu vzniku (chloridy, kyanidy, apod.).
Mnohé kovy mohou mít větší sklon k tomu, aby na jejich povrchu vznikala pasivní vrstvy, než kovy jiné. Tak např. z uvedených kovů se nejsnadněji pasivuje titan, pak chróm, cín, a následuje železo, mangan, olovo, stříbro, nikl, kobalt.
Z experimentálních zkušeností vyplývá, že kovy, u nichž oblast pasivity přesahuje pás stability vody, se dobře pasivují, aktivní se však velmi nesnadno pasivují (např. titan, chróm, cín). Železo se pasivuje mezi pH 9-13. Pod pH 9 pasivace železa musí být relativně velmi snadná.
Rozpouštění kovů – leptání
Leptáním rozumíme rozpouštění povrchu kovů pomocí kyselin, nebo solí, urychlované někdy účinkem elektrického proudu. Jeho průběh je dán vnějšími nebo vnitřními podmínkami.
A Vnější podmínky
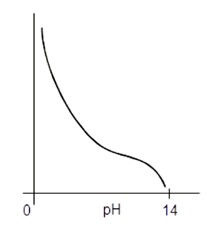
Největší vliv má hodnota pH roztoku. U železa rozpouštění prakticky neprobíhá při vysoké hodnotě pH.
Znázornění rychlosti rozpouštění kovů na hodnotě pH roztoku (obr.12) ukazuje, že za určitých podmínek je kov značně odolný proti rozpouštění, např.:
1) V důsledku termodynamické rovnováhy.
2) Když je kov je poměrně odolný v důsledku pasivity. (Příčinou pasivity je vznik tenkého, neviditelného a nesnadno rozpustného povlaku kysličníku, který brání rozpuštění kovu).
3) Je – li kov odolný, v důsledku toho, že se na jeho povrchu vytvořily málo rozpustné a dostatečně hutné krycí vrstvy. 4)Je kov je odolný i v případě, že neobsahuje příměsi jiných kovů.
![Obr. 13. Znázornění rozpustnosti slitin Cu – Au v kyselině dusičné při teplotě 90 °C [1]](/img/content/o13.jpg)
Obr. 12. Znázornění rychlosti rozpouštění Fe, Ni, Cd, Mg v závislosti na hodnotě pH [1]
Obr. 13. Znázornění rozpustnosti slitin Cu – Au v kyselině dusičné při teplotě 90 °C [1]
![Obr. 14. Mechanizmus vzniku koroze kovu ve styku s elektroizolačním materiálem [1]](/img/content/o14.jpg)
Obr. 14. Mechanizmus vzniku koroze kovu ve styku s elektroizolačním materiálem [1]
B Vnitřní podmínky
Ty jsou dány zejména druhem leptaného materiálu. Vliv leptadla je dán Tammanovým zákonem U některých kovů se mění rychlost rozpouštění skokem, viz obr. 13.
Skok se objevuje při koncentracích 1/8, 2/8, 4/8 molu ( mol je molekulová hmotnost vyjádřená v gramech). Ostrost kresby ovlivňuje především hrubá krystalická struktura kovu. Tloušťka odleptané vrstvy se mění od zrna k zrnu. Rychlost leptání závisí na krystalografické orientaci jednotlivých zrn. V případě, že materiál obsahuje vměstek jiné hmoty s odlišnou leptací rychlostí, bývá vyleptaná plocha nerovná. Při elektrolytickém leptání jsou leptané předměty připevněny na kladný pól (anodu) a jako katoda slouží ocelový plech. Leptací lázeň (roztoky kyselin) se spotřebovávají pomalu. Proudová hustota se pohybuje v rozmezí 5 až 10 A/dm2 při napětí 5 až 8 V. Doba leptání je 5 až 60 min [2].
(pokračování)
Působení bludných proudů na kovové konstrukce a jejich degradace (1)



